新春伊始,万象更新。博辉瑞进迎来新春“开门红”,旗下用于引导骨再生的可吸收口腔生物膜Oral Matrix产品获得美国食品药品监督管理局(FDA)510(k)批准,这也是国内首个获得美国FDA 510(k)批准的SIS材料口腔生物膜产品!
此次获批,是博辉瑞进在生物科技领域砥砺前行的又一个重要的里程碑,不仅为博辉瑞进的发展打开了更为广阔的国际市场,更标志着我们的技术实力和创新研发能力已达到国际先进水准,获得国际认可!
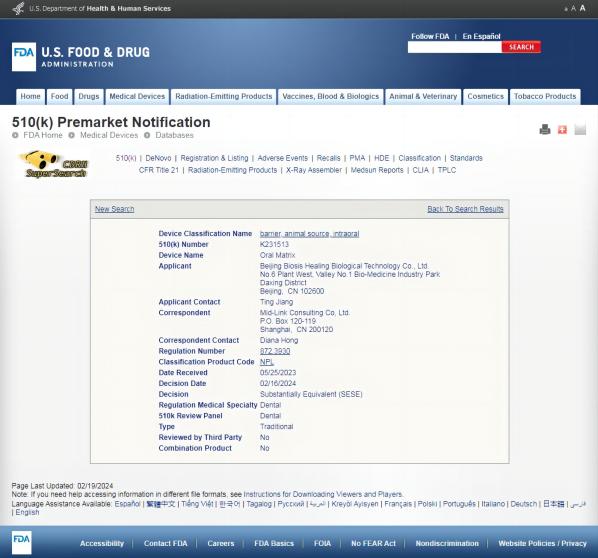
FDA认证:标准严格 值得信赖
美国食品药品监督管理局(FDA)是世界上最大的食品与药物管理机构之一。通过FDA认证的食品、药品、化妆品和医疗器械等产品,被全球公认为是对人体有效且能够确保安全的产品,是产品品质与效果的全球最高标准证明。
FDA 510(k)是FDA的一种市场准入途径,用于评估新的医疗器械是否与已经上市的同类器械具有相似的安全性和有效性。能够获得FDA 510(k)的批准,意味着博辉瑞进可吸收口腔生物膜Oral Matrix产品的安全性和有效性得到了充分验证且值得高度信赖。
关于可吸收口腔生物膜Oral Matrix
可吸收口腔生物膜Oral Matrix,采用博辉瑞进具有完全自主知识产权的脱细胞猪小肠粘膜下层基质材料(SIS材料)为原料制备而成,双层结构设计,非交联工艺制作。适用于拔牙窝位点保存,维持或防止充填材料移动,是组织修复和高效成骨的有力保障。
非交联工艺制作。无化学试剂添加,随组织再生,产品可完全降解吸收、无异物残留,减轻患者痛苦。
高生物诱导活性。SIS材料富含生物活性物质,可促进细胞贴附和组织再生,促进黏膜快速爬行覆盖缺损区域,加快患者恢复进程。
双面结构设计。植入口腔受损区域后,致密面可起到屏障保护作用,可有效防止上皮细胞和结缔组织长入骨缺损区,有效屏障周期可达8周;疏松面纤维松散,具有大孔隙,植入后即开始诱导血管生成,6周促进组织修复及引导骨再生,形成编织骨。
耐受感染。具有耐受感染抑菌机制,可耐受感染,对创面起到隔离保护作用,是临床上较为理想的口腔生物膜产品。
里程碑式跨越,持续创造价值
作为国内首个获得美国FDA 510(k)批准的SIS材料口腔生物膜产品,本次获批不仅意味着博辉瑞进在SIS生物材料领域的研发创新能力和技术实力得到国际认可,为企业扬帆全球化开启新的篇章,更是代表中国SIS生物材料研发生产企业,在全球SIS生物材料领域打造出了一张“中国名片”,展现了来自中国SIS生物材料企业的魅力和风采。
未来,博辉瑞进将继续秉承“创新 研发”为本的理念,在生物科技领域深耕不缀,致力于为全球患者提供更可靠、更先进、更全面的外科临床解决方案,让中国创新产品服务全球患者,为人类生命健康事业持续创造价值。

6月11日,由中华口腔医学会主办的“口腔...

近日,《中华胸心血管外科杂志》2024年...

2024年5月9日,在VBEF未来医疗生...

新春伊始,万象更新。博辉瑞进迎来新春“开...

12月22日,《陕西省际联盟硬脑(脊)膜...

落叶飘零随风拂,初冬悄然而至。随着冬天一...

清风入梦时,春和正景明。四月芳菲至,等你...

对一个家庭来说,最大的喜事之一,莫过于添...

截止目前,全球已有十余款新冠疫苗在多个国...

产品名称:新型冠状病毒(2019-nC...
版权所有北京博辉瑞进生物科技有限公司 京ICP备16026579号 (京)-非经营性-2017-0030  京公网安备 11011502006176号 (京)网药械信息备字(2022)第00096号
京公网安备 11011502006176号 (京)网药械信息备字(2022)第00096号